抗肿瘤生物类似药治疗药物监测药学专家共识

抗肿瘤生物类似药治疗药物监测药学专家共识
中国药理学会,中日友好医院
摘要 为规范抗肿瘤生物类似药个体化治疗在临床中的应用,指导临床药师以治疗药物监测为切入点,参与抗肿瘤生物类似药临床治疗的全程药学监护,中国药理学会和中日友好医院共同发起制定了本共识。该共识涵盖了临床治疗中进行抗肿瘤生物类似药治疗药物监测的必要性、个体化监测方案要点、临床药师对结果的解读及参与治疗等,旨在发挥临床药师在临床治疗中的技术支撑作用,保障患者最大程度获益。
关键词 抗肿瘤生物类似药;医疗机构;治疗药物监测;专家共识
Expert Consensus on the Therapeutic Drug Monitoring of Antitumor biosimilars
Chinese Pharmacological Society, China-Japan Friendship Hospital
ABSTRACT In order to guide and standardize the pharmaceutical departments medical institutions and Hospital pharmacists to use the technology of therapeutic drug monitoring (TDM) to participate integrated pharmaceutical care in the clinical application of antitumor biosimilars (AtBs),the Chinese Pharmacological Society and China-Japan Friendship Hospital jointly initiated and formulated this consensus. This consensus clarifies the necessity of TDM for ATBS in clinical application, individualized monitoring scheme, and participation of pharmacists, which could help pharmacists to play an important role in the technical support of clinical treatment and ensure the maximum benefit of patients.
KEYWORDS Antitumor biosimilars; Medical institutions; Therapeutic drug monitoring; Expert consensus
一、共识背景
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品,其注册临床试验的监管评估要点主要包括:免疫原性、药物代谢动力学(pharmacokinetics,PK)/药物效应动力学(pharmacodynamics,PD)以及临床疗效比较研究[1-4]。
2004年,欧洲药品管理局(European medicines agency,EMA)发布《生物类似药指南(草案)》,截至2019年9月,欧盟已审批通过了62个生物类似药。2010年3月,美国颁布了《生物制品价格竞争与创新法案(2009年)》,制定了有关生物类似药审批的内容,目前美国已审批通过24个生物类似药。2009年,日本参照欧盟的生物类似药监管体系框架,发布了生物类似药研发注册、审评审批等指导文件,截至2019年6月,日本共批准了18个生物类似药产品上市。我国相对于欧美等发达国家在生物类似审批数量上存在较大差距,目前已有4个生物类似药获批[5,6]。其中,已在国内获批上市的抗肿瘤生物类似药(Antitumor biosimilars,AtBs)利妥昔单抗和贝伐珠单抗,获得了其参照药的大部分适应症。
靶向抗肿瘤药物治疗大大延长了肿瘤患者的生存期,改善了其生活质量。AtBs为大分子单克隆抗体(monoclonal antibodies, mAbs)制剂,有贝伐珠单抗、利妥昔单抗和曲妥珠单抗三种注射剂上市。随着西妥昔单抗、帕妥珠单抗和地诺单抗等mAbs专利保护到期,将有越来越多的抗肿瘤生物类似药上市。AtBs药物的特殊性,加之基于临床治疗的有效性及安全性数据缺乏,对该类药物临床合理用药及药学服务提出了挑战。
虽然众多研究表明,与参照药相比,贝伐珠单抗、利妥昔单抗、曲妥珠单抗的生物类似物具有相近的疗效、安全性及免疫原性[5,7],但值得注意的是单克隆抗体特殊的体内药代动力学特征:非线性动力学、个体差异大、非特异性途径消除、特异性靶标介导药物处置等,使其具有PK/PD复杂性[8]。基于此,多个研究支持开展AtBs治疗药物监测(therapeutic drug monitoring, TDM),以实施个体化治疗策略[9,10]。
TDM是一门研究个体化药物治疗机制、技术、方法和临床标准,并将研究结果转化应用于临床治疗,以达到最大化合理用药的药学临床学科,通过测定患者体内的药物暴露、药理标志物或药效指标,利用定量药理模型,以药物治疗窗为基准,制订适合患者的个体化给药方案。其核心是个体化药物治疗[11]。
鉴于AtBs药理的复杂性、患者个体内及个体间的差异、AtBs真实世界证据的局限性,亟待对AtBs进行基于个体化治疗策略的治疗药物监测,发挥临床药师在临床治疗中的技术支撑作用,以保证患者最大程度的获益。
二、本共识适用范围及目的
目前临床使用的AtBs主要有利妥昔单抗、贝伐珠单抗和曲妥珠单抗三种mAbs。本共识聚焦AtBs的TDM,旨在为临床合理使用AtBs提供药学技术支持,解决现阶段证据支持层面不足所面临的临床治疗问题,为各级医疗机构临床医生和药师提供参考。
三、共识制定方法
采用名义群体法,由临床专家和药学专家组成指导专家组,共同讨论确定共识涉及的相关专业问题。共识起草组针对上述问题进行系统检索与分析,整理研究证据,并根据我国现状及研究证据做出相应推荐意见。采用德尔菲法问卷方式,开放收集国家及省市多个TDM及组织计72位专家意见。指导专家组最后审核修订调查结果,就推荐意见通过形成共识。
四、抗肿瘤生物类似药TDM相关问题及处理建议
1.抗肿瘤生物类似药实施TDM是否必要
1.1 抗肿瘤生物类似药(AtBs)是单克隆抗体药物,与参照药一样具有生物制剂特有的复杂性,具有以药物暴露为特征的较大药代动力学(PK)个体差异,同时药效动力学(PD)受多重因素影响,推荐对接受该类药物治疗的患者实施TDM;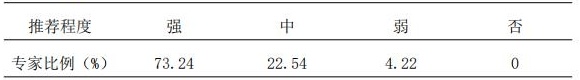
1.2 实施AtBs的TDM时,推荐专科药师参与全程治疗;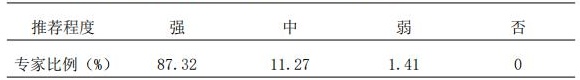
1.3 专科药师应对目标患者进行药物重整,以协助主治医师实施个体化治疗。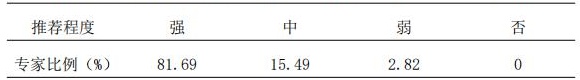
2.如何个体化制定抗肿瘤生物类似药监测方案
2.1 临床药师根据患者情况进行用药评估,患者用药应符合药品说明书;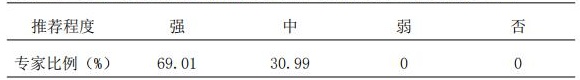
2.2 针对情况复杂的患者,还应该充分参考参照药说明书;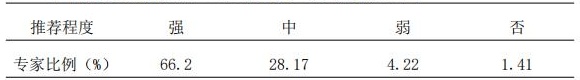
2.3 初始使用AtBs、进行AtBs与其参照药或进行AtBs之间转换时,推荐专科药师制定风险管控计划,以最大程度满足患者安全获益;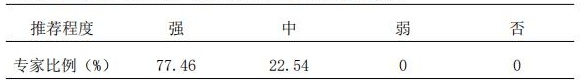
2.4 在制定初始治疗方案时,推荐检测药物相关基因及基因多态性;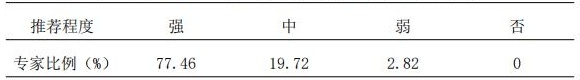
2.5 计算药物剂量时应考虑患者体重指数(BMI)的影响。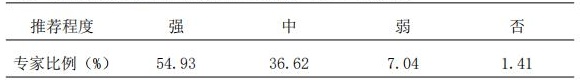
3.如何在治疗过程中调整抗肿瘤生物类似药方案
3.1 AtBs的治疗方案调整应根据患者的PK/PD特征进行,推荐综合考虑t1/2、AUC、Cl、Css、V等参数;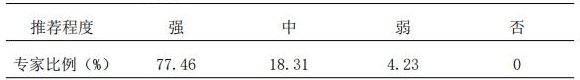
3.2 药物血清浓度是反映患者PK的标志指标,推荐进行常规监测;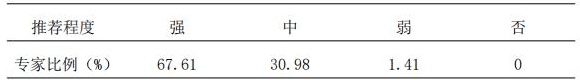
3.3 药物抗药抗体(ADA)血清浓度是药物疗效和风险控制的参考指标,推荐进行常规监测。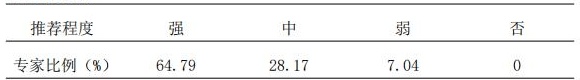
4.抗肿瘤生物类似药血药浓度的检测方法
4.1 推荐建立液相色谱-质谱分析方法(LC-MS)测定贝伐珠单抗、曲妥珠单抗和利妥昔单抗的血药浓度,并进一步评价血清、血浆与全血样本的测定差异性;
4.2 推荐采用免疫法测定贝伐珠单抗、曲妥珠单抗和利妥昔单抗的血清药物浓度,但需充分认识免疫测定方法和LC-MS方法的差异性。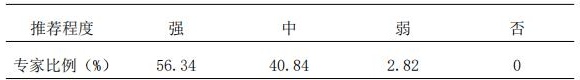
5.是否需要在使用抗肿瘤生物类似药时检测相关基因
5.1 推荐开展AtBs敏感性、不良反应、PK/PD以及抗药物抗体相关基因及基因多态性检测,以强化该类药物个体化治疗的信息相关性。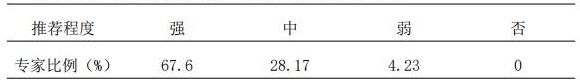
6.抗肿瘤生物类似药相关基因的检测方法
6.1 推荐使用DNA测序、免疫组化(IHC)、荧光原位杂交(FISH)、双色银染原位杂交(DSISH)和循环肿瘤ctDNA等方法检测生物类似药相关基因。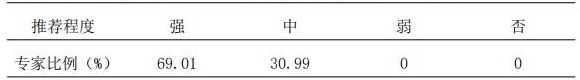
7.药师在抗肿瘤生物类似药临床治疗中的作用
7.1 推荐针对患者用药制定ADR与毒副作用监测比对记录,针对生物制剂参照药、治疗方案合并用药制定比对表,专科药师实施目标监测。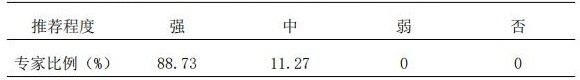
8.药师在抗肿瘤生物类似药临床评价中的作用
8.1 针对不具有TDM实验室技术支持条件的医疗机构,推荐由专科药师有条件的开展药品有效性、经济性快速评估,建立快速评估评价指标,及时获得效果结局判断,以保障患者获益。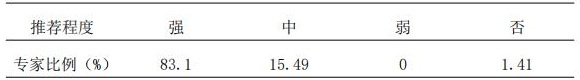
五、附则
1. 共识制定利益声明
共识专家和共识起草成员均要求填写利益声明表,并对存在利益冲突的成员进行管理。
本共识获得中国药理学会立项批准并提供专项经费支持;同时按照学会相关规定合法接受不限于一家企业的资助,以承担课题组成员参与本共识制定的费用,但资助企业不参与共识证据综合、评价和推荐意见制定的过程。
2. 共识文件更新周期
本共识全文预计将于2020年5月发布,共识及共识解读将在相关领域的期刊上发表。本共识更新周期初步定为1年。
六、共识专家(按姓氏笔画排序)
执笔人
张相林(中日友好医院)
覃旺军(中日友好医院)
编写秘书组
陈文倩(中日友好医院)
柳芳(中日友好医院)
韩俊萍(苏州大学第二附属医院)
李沭(中日友好医院)
王玮(中日友好医院)
田如新(北京中医医院顺义医院)
张爽(中日友好医院)
指导专家组(排名不分先后)
王卓(上海长海医院)
杜冠华(中国医学科学院北京协和医学院药物研究院)
李国辉(中国医学科学院肿瘤医院)
李晓宇(复旦大学附属中山医院)
李焕德(中南大学湘雅二医院)
杨申淼(北京大学人民医院)
肖洪涛(四川省肿瘤医院)
邱峰(重庆医科大学附属第一医院)
张伶俐(四川大学华西第二医院)
张翼鷟(中山大学附属肿瘤医院)
武新安(兰州大学第一医院)
范磊(江苏省人民医院)
赵志刚(首都医科大学附属北京天坛医院)
赵荣生(北京大学第三医院)
贺鹏程(西安交通大学第一附属医院)
顾景凯(吉林大学生命科学学院)
郭瑞臣(山东大学齐鲁医院)
董梅(哈尔滨医科大学附属肿瘤医院)
童荣生(四川省医学科学院·四川省人民医院)
缪丽燕(苏州大学附属第一医院)
肇丽梅(中国医科大学附属盛京医院)
张相林(中日友好医院)
参考文献
[1] 国家食品药品监督管理局. 国家食药监管总局发布生物类似药研发与评价技术指导原则[J]. 中国医药生物技术,2015,10(02);156.
[2]Aschenbrenner D S. FDA Offers Educational Resources on Biosimilar and Interchangeable Products[J]. Am J Nurs,2018,118(2);46.
[3] Sharma A, Khante S, Mahadik K R, et al. Regulatory Perspective of International Agencies for Development of Biosimilar Products (Monoclonal Antibodies): An Overview[J]. Ther Innov Regul Sci,2020.
[4] Arato T, Yamaguchi T. Experience of reviewing the follow-on biologics including Somatropin and erythropoietin in Japan[J]. Biologicals,2011,39(5);289-292.
[5] 覃旺军,李沭,王玮,等. 抗肿瘤生物类似药的临床研究与应用[J]. 中国医院用药评价与分析,2019,19(11);1281-1285.
[6] 覃旺军,韩俊萍,李沭,等. 抗肿瘤生物类似药治疗药物监测指南制定计划书思考[J]. 中国医院用药评价与分析,2019,19(12);1409-1412.
[7] Sharman J P, Liberati A M, Ishizawa K, et al. A Randomized, Double-Blind, Efficacy and Safety Study of PF-05280586 (a Rituximab Biosimilar) Compared with Rituximab Reference Product (MabThera((R))) in Subjects with Previously Untreated CD20-Positive, Low-Tumor-Burden Follicular Lymphoma (LTB-FL)[J]. BioDrugs,2020,34(2);171-181.
[8] Widmer N, Bardin C, Chatelut E, et al. Review of therapeutic drug monitoring of anticancer drugs part two--targeted therapies[J]. Eur J Cancer,2014,50(12);2020-2036.
[9] Bardin C, Veal G, Paci A, et al. Therapeutic drug monitoring in cancer--are we missing a trick?[J]. Eur J Cancer,2014,50(12);2005-2009.
[10] Gao B, Yeap S, Clements A, et al. Evidence for therapeutic drug monitoring of targeted anticancer therapies[J]. J Clin Oncol,2012,30(32);4017-4025.
[11] 张相林,缪丽燕,陈文倩. 治疗药物监测工作规范专家共识(2019版)[J]. 中国医院用药评价与分析,2019,19(08);897-898.


 京公网安备11010502042549号
京公网安备11010502042549号